Фигурин
Содержание:
- Клиническое значение
- Физические и химические свойства[править | править код]
- Воздействие на животных
- В чем отличия между дегенеративными изменениями и поражениями?
- Структура и механизм действия
- Полезные мутации — дар или наказание?
- Блокаторы миостатина
- Мутации — двигатель эволюции живых организмов
- В популярной культуре
- 3 задачи терапии
Клиническое значение
Мутации
Разработана методика обнаружения мутаций в вариантах миостатина. Мутации, снижающие выработку функционального миостатина, приводят к разрастанию мышечной ткани. Связанная с миостатином мышечная гипертрофия имеет неполный аутосомно- доминантный тип наследования. Люди с мутацией в обеих копиях гена MSTN в каждой клетке ( гомозиготы ) значительно увеличили мышечную массу и силу. Люди с мутацией в одной копии гена MSTN в каждой клетке ( гетерозиготы ) имеют увеличенную мышечную массу, но в меньшей степени.
В людях
В 2004 году у немецкого мальчика была диагностирована мутация в обеих копиях гена, продуцирующего миостатин, что сделало его значительно сильнее, чем его сверстники. У его матери есть мутация в одной копии гена.
Американскому мальчику, родившемуся в 2005 году, был поставлен диагноз клинически схожего состояния, но с несколько иной причиной: его организм вырабатывает нормальный уровень функционального миостатина, но поскольку он сильнее и мускулистее, чем большинство других его сверстников, у него имеется дефект миостатина. Считается, что рецепторы мешают его мышечным клеткам нормально реагировать на миостатин. Он появился в телешоу World’s Strongest Toddler .
Лечебный потенциал
Дальнейшие исследования миостатина и гена миостатина могут привести к лечению мышечной дистрофии . Идея состоит в том, чтобы ввести вещества, блокирующие миостатин. Моноклональное антитело специфического для антимиостатиновога увеличивается мышечной массы у мышей и обезьян.
Двухнедельное лечение нормальных мышей растворимым рецептором активина типа IIB , молекулой, которая обычно прикрепляется к клеткам и связывается с миостатином, приводит к значительному увеличению мышечной массы (до 60%). Считается, что связывание миостатина с растворимым рецептором активина предотвращает его взаимодействие с рецепторами, связанными с клеткой. В сентябре 2020 года ученые сообщили, что подавление рецепторов активина типа 2 — сигнальных белков миостатина и активина A с помощью активина A / ингибитора миостатина ACVR2B — предварительно протестированного на людях в форме ACE-031 в начале 2010-х годов — может защитить как от и от у мышей. Мыши были отправлены на Международную космическую станцию и могли в значительной степени поддерживать свой мышечный вес — примерно вдвое больше, чем у дикого типа, благодаря генной инженерии, направленной на удаление гена миостатина — в . Лечение прогерических мышей растворимым рецептором активина типа IIB до появления признаков преждевременного старения, по-видимому, защищает от потери мышечной массы и задерживает возрастные признаки в других органах.
Остается неясным, приносит ли пользу длительное лечение мышечной дистрофии ингибиторами миостатина, поскольку истощение мышечных стволовых клеток может в дальнейшем усугубить заболевание. По состоянию на 2012 год на рынке отсутствуют препараты, ингибирующие миостатин. Антитело, созданное с помощью генной инженерии для нейтрализации миостатина, stamulumab , которое разрабатывала фармацевтическая компания Wyeth , больше не разрабатывается. Некоторые спортсмены, желающие заполучить такие препараты, обращаются к Интернету, где продаются поддельные «блокаторы миостатина».
Упражнения с отягощениями и добавление креатина приводят к более значительному снижению уровня миостатина.
Уровни миостатина можно временно снизить с помощью нокдауна гена siRNA, конъюгированного с холестерином.
Спортивное использование
Подавление миостатина приводит к гиперплазии и гипертрофии мышц . Ингибиторы миостатина могут улучшить спортивные результаты, поэтому есть опасения, что этими ингибиторами можно злоупотреблять в спорте. Однако исследования на мышах показывают, что ингибирование миостатина напрямую не увеличивает силу отдельных мышечных волокон. Ингибиторы миостатина специально запрещены Всемирным антидопинговым агентством (WADA). В 12 августа 2012, интервью National Public Radio , Карлон Колкер заявил , что «когда ингибиторы миостатина приходят, они будут злоупотребляли. Там нет сомнений в моей голове.»
Физические и химические свойства[править | править код]
Кривая взаимной растворимости никотина и воды с двумя критическими точками: нижней при 60 °С и верхней при 210 °С. На оси абцисс указана никотина
Никотин представляет собой гигроскопичную маслянистую жидкость с горьким вкусом, легко смешивается с водой (при температурах ниже 60 °С и выше 210 °С) в основной форме. Плотность никотина почти равна плотности воды (1,01 г/см3).
Молекула никотина состоит из пиридинового и пирролидинового циклов. Пирролидиновый цикл принимает конформацию «конверт» с транс-расположением пиридинового цикла и N-метильной группы.
Являясь основанием (pKb (пирролидин) = 8,02, pKb (пиридин) = 3,12), никотин при реакции с кислотами образует соли (обычно, твёрдые и водорастворимые). Сорбция никотина через биологические мембраны зависит от pH и для слизистых оболочек ускоряется при высоких значениях pH, когда молекула никотина не имеет заряда. При физиологических значениях pH никотин протонирован на 69 %. Никотин малополярен и хорошо растворим в средах с низкой полярностью, поэтому он хорошо всасывается через кожу и проникает в ткани мозга через гемато-энцефалический барьер.
Никотин легко окисляется до нетоксичной и физиологически важной в организме теплокровных животных никотиновой кислоты — витамина PP, при этом пирролидиновый цикл заменяется карбоксильной группой. Также под действием разных окислителей и ультрафиолетового излучения никотин окисляется до метиламина и окиси никотина.
Воздействие на животных
Двумускулистый скот
Бельгийский голубой рогатый скот
После этого открытия несколько лабораторий клонировали и установили нуклеотидную последовательность гена миостатина у двух пород крупного рогатого скота, бельгийской голубой и пьемонтской . Они обнаружили мутации в гене миостатина (различные мутации у каждой породы), которые так или иначе приводят к отсутствию функционального миостатина. В отличие от мышей с поврежденным геном миостатина, у этих пород крупного рогатого скота мышечные клетки скорее размножаются, чем увеличиваются. В народе эти породы крупного рогатого скота описываются как «двумускулистые», но общее увеличение всех мускулов составляет не более 40%.
Животные, лишенные миостатина, или животные, получавшие такие вещества, как фоллистатин, которые блокируют связывание миостатина с его рецептором, имеют значительно большие мышцы. Таким образом, снижение уровня миостатина может потенциально принести пользу животноводческой отрасли , при этом даже 20-процентное снижение уровня миостатина потенциально может иметь большое влияние на развитие мускулов.
Однако породы животных, выведенные как гомозиготные по дефициту миостатина, имеют из-за их необычно тяжелого и громоздкого потомства и требуют особого ухода и более дорогой диеты для достижения превосходного урожая. Это отрицательно влияет на экономику пород с дефицитом миостатина до такой степени, что они обычно не дают очевидного преимущества. В то время как гипертрофическое мясо (например, из ) имеет место на специализированном рынке из-за его высоких вкусовых качеств и нежности, по крайней мере, для чистопородных штаммов с дефицитом миостатина затраты и (особенно в отношении крупного рогатого скота) необходимость ветеринарного надзора ставят их в невыгодное положение. оптовый рынок.
Уиппеты
«Уиппет-хулиган» с гомозиготной мутацией миостатина.
Уиппеты могут иметь мутацию миостатина, которая включает делецию двух пар оснований и приводит к усеченному и, вероятно, неактивному белку миостатина .
Животные с гомозиготной делецией имеют необычную форму тела, с более широкой головой, выраженным прикусом, более короткими ногами и более толстыми хвостами, и в сообществе разведения их называют «хулиганами». Хотя они значительно более мускулисты, они менее способные бегуны, чем другие уиппеты. Однако уиппеты, гетерозиготные по мутации, были значительно перепредставлены в высших гоночных классах.
Кролики и козы
В 2016 году система CRISPR / Cas9 использовалась для генной инженерии кроликов и коз без функциональных копий гена миостатина. В обоих случаях полученные животные были значительно мускулистее. Однако у кроликов без миостатина также наблюдался увеличенный язык, более высокая частота мертворождений и сокращенная продолжительность жизни.
Свиньи
Южная Корея — китайская команда спроектировала «двойная» мышцу свиней, как и с крупным рогатым скотом, стремясь к более дешевым породам для мясного рынка. Возникли такие же проблемы со здоровьем, как и у других млекопитающих, например, затруднения при родах из-за чрезмерного размера.
В чем отличия между дегенеративными изменениями и поражениями?
Дегенеративные процессы в суставах не всегда опасны. Их разделяют на изменения и поражения:
- изменения – это естественный процесс старения суставов, который не оказывает серьезного влияния на их функциональность;
- поражения – это патологическое состояние, которое возникает в любом возрасте и приводит к развитию артроза колена, плеча или тазобедренного сустава.
Дегенеративные поражения могут иметь не одну, а несколько причин, которые накладываются и усиливают друг друга. Например, хрящ может быть генетически неполноценным, сустав может иметь анатомические дефекты или травматические повреждения. Развитию заболевания способствуют перегрузка, воспаление сустава, патология эндокринной системы. Одна или несколько причин запускают механизм разрушения сустава изнутри.
Структура и механизм действия
Человеческий миостатин состоит из двух идентичных субъединиц, каждая из которых состоит из 109 (в базе данных NCBI утверждается, что человеческий миостатин имеет длину 375 остатков) аминокислотных остатков . Его общая молекулярная масса составляет 25,0 кДа
Белок неактивен до тех пор, пока протеаза не расщепит NH2-концевую или «продоменную» часть молекулы, в результате чего образуется активный COOH-концевой димер. Миостатин связывается с рецептором активина типа II , что приводит к привлечению корецептора Alk-3 или Alk-4 . Это корецептор затем инициирует сигнальные клетки каскада в мышцах , которая включает активацию факторов транскрипции в Smad Семейно SMAD2 и SMAD3 . Эти факторы затем индуцируют регуляцию генов, специфичных для миостатина . При нанесении на миобласты миостатин подавляет их пролиферацию и либо инициирует дифференцировку, либо стимулирует покой.
В зрелых мышцах миостатин ингибирует Akt , киназу, достаточную для того, чтобы вызвать мышечную гипертрофию , частично за счет активации синтеза белка при одновременном стимулировании выработки убиквитинлигаз, белков, которые регулируют распад мышечного белка. Однако Akt не отвечает за все наблюдаемые гипертрофические эффекты мышц, которые опосредованы ингибированием миостатина. Таким образом, миостатин действует двумя путями: ингибируя Akt-индуцированный синтез белка и стимулируя регулируемую убиквитином деградацию белка.
Полезные мутации — дар или наказание?
87% тибетцев имеют мутацию в гене EPAS1, позволяющую им комфортно дышать разреженным горным воздухом: высота Тибетского плато составляет 4 тыс. м над уровнем моря, и здесь на 40% меньше кислорода, чем на равнине.
Житель низины не смог бы так жить, у него развилась бы высотная болезнь: головные боли, быстрая утомляемость, детская смертность была бы гораздо выше, чем у жителей гор. У тибетцев нет ни одной из этих проблем. Однако часто такие особенности имеют изнанку.
В 1994 году стала известна история о людях со сверхпрочным скелетом: в Коннектикуте (США) из страшной автокатастрофы водитель вышел без единого перелома. Рентгеновские снимки показали аномально плотные кости. Мужчину отправили в Йельский костный центр где обнаружилось, что его кости плотнее скелета обычного человека такого же возраста в восемь раз.
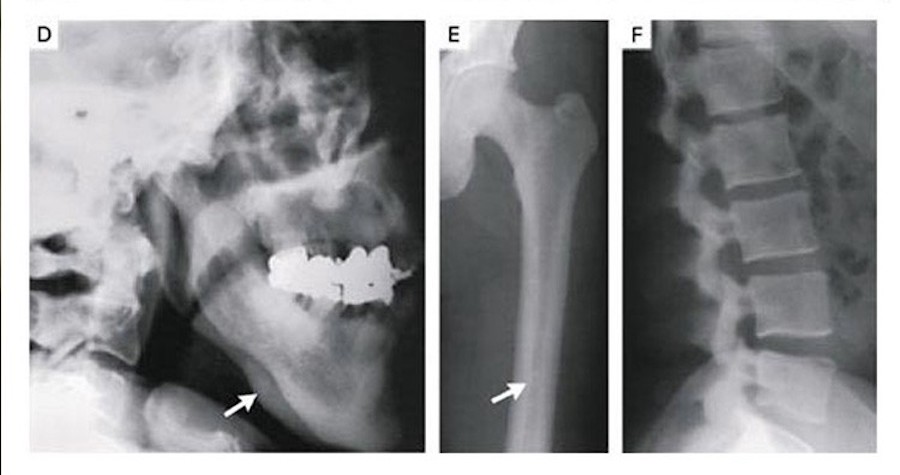
Высокая плотность костей из-за мутации в гене LRP5, которая обычно ведет к остеопорозу
(Фото: New England Journal of Medicine)
Позже выяснилось, что никто из его родных никогда ничего себе не ломал и не жаловался на ушибы. Исследования ДНК выявили мутацию в гене LRP5, сделавшую этих людей невероятно устойчивыми к различным повреждениям и ударам. Однако мужчина пожаловался, что ему никогда не удавалось держаться на воде, он всегда считал себя слишком тяжелым для плавания.
«С одной стороны, такие плотные кости менее ломкие, и человеку комфортно жить, осознавая, что риск получить переломы и травмы минимален. С другой стороны, такая плотность костей означает, что человек с большей вероятностью может утонуть, он менее плавучий, в отличие от того, у кого кости более полые», — объясняет Оксана Максименко, руководитель Центра высокоточного редактирования и генетических технологий для биомедицины ИБГ РАН.
Носители мутации G6PD-Mahidol487A, затрагивающей ген фермента G6PD, практически невосприимчивы к малярии. Изменение в структуре серповидноклеточного белка гемоглобина делает эритроцит устойчивым к малярийному плазмодию, передаваемому через укусы комаров.
Естественный отбор позаботился о том, чтобы особенность прижилась в Азии и Африке, страдающих от малярии. Это очень опасный для жизни недуг: в 2019 году от него скончались 274 тыс. детей в возрасте до 5 лет (67% от всех «малярийных» смертей в мире).
Однако, например, от 18% до 25% населения юго-восточной Азии эта болезнь не страшна. Ученые из Института Пастера (Франция) и Университета Махидол (Таиланд) провели крупномасштабное эволюционное и эпидемиологическое исследование и доказали, что мутация позволяет своим обладателям не заболеть от укуса заразного комара, ответственного за половину всех случаев малярии в регионе.
«То же самое с ВИЧ-инфекцией: мутация поддерживается естественным отбором в регионах с высокой инфицированностью. Чтобы проникнуть внутрь клетки, вирус иммунодефицита должен присоединиться к рецептору, белку на поверхности, — говорит Константин Крутовский — У некоторых людей мутация в гене CCR5 изменила этот рецептор, и вирус не может к нему «прицепиться». Вероятность проникнуть внутрь клетки и вызвать заболевание у таких людей очень низкая. Фактически 3–6 людей из 1 000 устойчивы к ВИЧ. У северных народов цифра повыше — 0,6%, у южных поменьше — 0,3%. Однако мутация может давать побочные эффекты, поскольку измененный рецептор на поверхности клетки — это не очень хорошо».
Побочным эффектом мутаций могут стать заболевания крови, например, серповидноклеточная анемия, которая несет целый ряд необратимых последствий: от детских ишемических инсультов, повреждения селезенки у взрослых, легочной гипертензии, почечной недостаточности до летальных исходов.
Мутация в генах SCN9A, SCN11A и PRDM12 куда более редка: известно о полутора сотнях носителей на всей планете. Ее обладатели совсем не чувствуют боли, как Эшлин Блокер из американского городка Паттерсон. Повреждения в генах влияют на нервы, несущие болевые сигналы в мозг.
Эшлин окунала руки в кипяток, сдирала кожу с ладоней под струей отцовской мойки высокого давления, два дня ходила со сломанной лодыжкой, была укушена сотней огненных муравьев и получила много других травм. Никакой боли при этом она не ощущала, зато на теле каждый раз оставались отметины и шрамы.
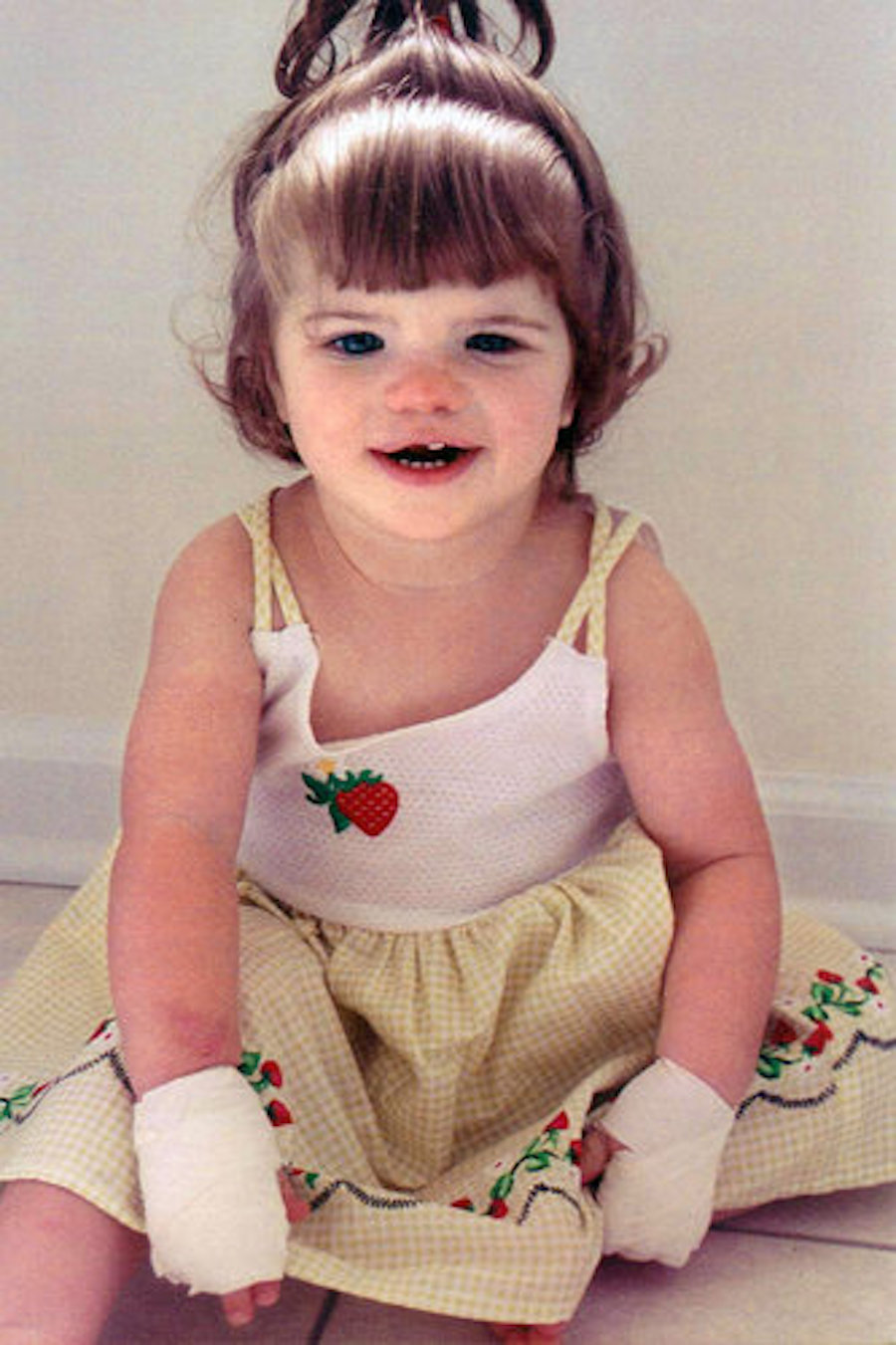
Будучи младенцем Эшлин чуть не откусила язык, когда у нее резались зубы
(Фото: из личного архива Тары Блокер)
Люди с такой мутацией редко доживают до 20 лет. Они могут погибнуть даже от аппендицита, потому что у них ничего не болит и проблему они замечают слишком поздно, когда уже началось смертельное воспаление. Эшлин Блокер сейчас 22 года, не так давно она попала в серьезное ДТП, отделавшись испугом.
Блокаторы миостатина
В настоящее время ведется разработка целого ряда блокаторов действия миостатина, однако на настоящий момент нет ни одного препарата одобренного к применению на людях.
Блокатор миостатина MYO-029 (Stamulumab)
Wyeth Pharmaceuticals в 2002 году начала разработку препарата MYO-029 (Stamulumab) — рекомбинантные антитела, которые связываются с миостатином и блокируют его эффекты.
В начале 2005 года Wyeth Pharmaceuticals при дополнительном финансировании MDA начала фазу 1-2 клинических исследований безопасности и переносимости MYO-029 (Stamulumab) на 116 испытуемых. Данные клинических испытаний были опубликованы только в январе 2008 года.
Препарат показал себя безопасным и хорошо переносимым в трех различных дозировках, о чем сообщено в отчете, опубликованном Kathryn Wagner с коллегами из Johns Hopkins University School of Medicine в Baltimore в журнале Annals of Neurology
Однако в марте 2008 года, после окончания клинических испытаний компания объявила о приостановке развития проекта MYO-029 (Stamulumab), так как ни у кого из обследуемых не было статистически значимого улучшения силы или роста мышц у участвующих в исследовании пациентов.
Элементы рецепторов ACVR2B как блокаторы миостатина
Большой потенциал имеет новый препарат ACVR2B, который представляет собой раствор элементов рецепторов к миостатину. Молекулярные элементы ACVR2B имеют участок, схожий с активным центром рецептора и связываются со свободным миостатином, блокируя его способность активировать рецепторы. Данный препарат был создан в 2005 году, под руководством все того же доктора Se-Jin Lee, Johns Hopkins University School of Medicine в Baltimore. Se-Jin Lee надеется, что ACVR2B может использоваться в ближайшем будущем и на людях, тогда как по состоянию на 2005 год он уже доказал высокую эффективность на лабораторных мышах. Команда доктора Se-Jin Lee апробировала различные дозы ACVR2B на 49 мышах и зафиксировала мышечный прирост после четырех недель применения препарата. Максимальные показатели мышечного прироста были достигнуты при двух инъекциях в неделю, в дозировке 50 мкг на килограмм массы тела. Мышечная масса этих мышей увеличилась на 61% по сравнению с исходной.
ACE-031
ACE-031 еще один перспективный препарат класса блокаторов миостатина, он представляет собой раствор экстрацеллюлярных частей рецепторов ActRIIB соединенных с Fc фрагментом иммуноглобулина G. Путем блокирования сигнала через рецептор ActRIIB, препарат увеличивает мышечную массу и силу. Предварительные испытания ACE-031 продемонстрировали высокую эффективность на экспериментальных моделях с животными.
В настоящее время ACE-031 проходит первую фазу клинических испытаний. В продаже доступны кустарные препараты от китайского производителя.
Модифицированные пропептиды миостатина
В качестве еще одного блокатора миостатина предложены модифицированные пропептиды миостатина , в частности мутированный пропептид миостатина D76A. Механизм действия препаратов весьма интересен. До тех пор, пока незрелый миостатин (предшественник миостатина) не подвергнется модификации под влиянием металлопротеиназы, он не будет оказывать свое действие. Применяя мутированные пропептиды миостатина, типа D76A происходит необратимое или частично-необратимое связывание с металлопротеиназой, после чего посттрансляционный процессинг промиостатина прекращается, а проще говоря, не образуется зрелый миостатин.
Пробы проводились только на животных, и данных о применении препаратов данной группы на людях пока нет.
Мутации — двигатель эволюции живых организмов
Слово «мутация» в обычной жизни окрашено, как правило, не в самые радужные цвета. На ум приходят патологии, заболевания и другие неприятные изменения организма. Однако мутации — это не добро или зло, но стандартный механизм природы. В живом организме такие изменения происходят постоянно. Клетки делятся все время и иногда делают это с ошибкой. Большинство неточностей тут же находит такой механизм организма, как репарация, и моментально исправляет.
Геном — это совокупность всех хромосом. Каждая хромосома состоит из ДНК и белков. Гены образованы из группы последовательных нуклеотидов и расположены по всей молекуле ДНК.
Но иногда, по разным причинам, например, когда ошибок очень много, репарация оказывается бессильна, и «неправильные» клетки продолжают развиваться с поломкой. Значительная часть мутаций обычно «вымывается» из популяции, как невыгодная: это делает естественный отбор, к тому же около 20% людей по разным причинам не оставляют потомства. Однако некоторые мутации закрепляются, в одних случаях они приводят к врожденным болезням, в других — могут вывести человечество на новый этап развития.
«Если мутация дает какое-то явное преимущество, — увеличивает приспособленность, вероятность выжить, повышает плодовитость, делает организм более адаптированным, то обычно этот вариант вытесняет все остальные. Очень быстро, в течение нескольких поколений, он фиксируется в популяции, что поддерживается естественным отбором. Вместо изменчивости, или иначе — полиморфизма генов, мы наблюдаем один вариант», — объясняет Константин Крутовский, профессор Гёттингенского университета (Германия), ведущий научный сотрудник Института общей генетики им. Н. И. Вавилова РАН, профессор кафедры геномики и биоинформатики Сибирского федерального университета.
Так случилось с нашими предками. Ученые Калифорнийского университета (Сан-Диего, США) обнаружили, что 2–3 млн лет назад у гоминид, древних предков современных людей, случилась мутация гена CMAH, благодаря которой у них появилось больше мышц, потовых желез, а также возросла выносливость. Эти новые особенности обеспечили первым людям доминирование над другими обитателями планеты: теперь они могли быстро бегать, причем на дальние расстояния, и охотиться днем в жару, когда другие хищники прятались в тени.
50 тыс. лет назад мигрировать из Африки на территорию современной Европы людям помогла мутация в гене ACTN3, кодирующем белок α-актинин-3. Благодаря ей предки европейцев смогли справиться с прохладным климатом, тело научилось обогревать само себя. Этот генотип редко встречается у этнических групп, живущих в жарких регионах: его имеет всего 1% кенийцев и нигерийцев.
В популярной культуре
Романы
Мутации гена миостатина цитируются ученым из Стэнфордского университета в романе « Аномалии производительности» , поскольку ученый оценивает мутации, которые могут объяснить ускоренную нервную систему главного героя шпионажа Cono 7Q.
Телевидение
В эпизоде «Смерть в семье» сериала «Невероятный Халк» (сериал 1978 года) врач вводит яд молодой наследнице, чтобы имитировать дегенеративное расстройство; флакон был намеренно неправильно маркирован миостатином, чтобы скрыть его. Дэвид Бэннер, очевидно, знал, как должен выглядеть настоящий миостатин, и знал, что его не было во флаконе.
3 задачи терапии
Задача № 1. Уменьшить боль.
Очень эффективны в остром периоде нестероидные противовоспалительные препараты. Ввиду серьезных побочных эффектов (желудочные кровотечения, проблемы с давлением) долго использовать их нельзя. Эти лекарства негативно сказываются на состоянии хряща и могут усугубить течение заболевания. Кроме них, показана лечебная физкультура, с помощью которой можно укрепить мышцы вокруг сустава и улучшить его подвижность. Это справедливо при условии регулярных занятий, за исключением периода обострения.
Задача № 2. Снять воспаление.
Если с этой задачей нестероидные противовоспалительные средства не справляются, дополнительно подключают инъекции в сустав гормонов-глюкокортикоидов. Эти препараты также негативно влияют на состояние хрящевой ткани, замедляют в ней метаболизм, приостанавливают регенеративные процессы
Поэтому прибегать к этому методу нужно крайне осторожно и в исключительных случаях
Рыба, холодец, желе – естественные источники глюкозамина
Задача № 3 – первоочередная. Остановить разрушение хряща.
Базовое средство – хондропротекторы с сульфатом хондроитина и глюкозамином, по отдельности или в комбинации. Они нужны для восстановления хрящевой ткани, приостанавливают ее разрушение и улучшают метаболизм. В состав некоторых новых препаратов включают серу и гиалуроновую кислоту.
- Сера, обладающая противовоспалительным свойством, уменьшает боль и купирует воспаление, что позволяет пациенту принимать нестероидные препараты в сниженной дозировке.
- Гиалуроновая кислота удерживает влагу в хрящевой ткани, которая в норме на 80 % состоит из воды.
Вместо того чтобы месяцами принимать хондропротекторы в надежде восстановить дефицит синовиальной жидкости, можно воздействовать на хрящ напрямую. Для этого на любой стадии лечения остеоартроза назначают внутрисуставные инъекции протеза синовиальной жидкости. Гель вводят в сустав, где он покрывает собой поврежденные хрящевые поверхности и прекращает трение.
По составу жидкий эндопротез «Нолтрекс» повторяет естественную синовиальную жидкость, поэтому он с легкостью замещает в суставе ее недостаток. Хрящ остается прежним, разрушенным и потрескавшимся, однако человек уже не испытывает боли при движениях. Гель увлажняет хрящевую ткань и приостанавливает ее дегенерацию, истощенный хрящ получает обновленное питание и новую жизнь!
При артрозе хрящевая ткань разрушается в ускоренном режиме: хрящу необходима помощь
Укрепить истощенный хрящ можно и с помощью ЛФК. Во время физических нагрузок кровоснабжение сустава улучшается, он получает больше питательных веществ. Однако лечебная физкультура не избавляет от трения и первопричины боли. Поэтому ортопеды все чаще рекомендуют, чтобы помочь хрящу, именно этот метод – внутрисуставные инъекции заменителя синовиальной жидкости.