Анаэробное окисление
Содержание:
- В сочетании с восстановлением нитратов и нитритов
- В сочетании с сульфатредукцией
- Эффект Пастера
- Степень аэробности среды
- Гликолиз
- Классификация анаэробов
- В сочетании с сульфатредукцией
- Аэробный режим энергообеспечения мышечной деятельности
- В сочетании с сульфатредукцией
- Что такое гликолиз
- В сочетании с восстановлением нитратов и нитритов
- Распространение и экологическое значение[править | править код]
В сочетании с восстановлением нитратов и нитритов
Общие реакции:
- CH 4 + 4 NO 3 — → CO 2 + 4 NO 2 — + 2 H 2 O
- 3 CH 4 + 8 NO 2 — + 8 H + → 3 CO 2 + 4 N 2 + 10 H 2 O
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. ANME-2d, названный Methanoperedens nitroreducens , способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве концевого акцептора электронов, используя гены восстановления нитратов, которые были переданы латерально от бактериального донора. Это также был первый полный путь обратного метаногенеза, включающий гены mcr и mer .
В 2010 году омики , особенно метагеномические , анализ показали, что восстановление нитрита может быть связано с окислением метана одним бактериальным видом Candidatus Methylomirabilis oxyfera ( тип NC10 ), без необходимости в архейном партнере.
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. Второй метод (в центре) связывает окисление метана с восстановлением нитратов, опосредованным консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH 4 + SO 4 2− → HCO 3 — + HS — + H 2 O
Сульфат-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных архей и сульфатредуцирующих бактерий . Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф ». ANME очень тесно связаны с метаногенными археями, и недавние исследования показывают, что AOM является ферментативным обращением метаногенеза . До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это потому, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не смогли изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что археи ANME и SRB имеют облигатное синтрофическое взаимодействие и поэтому не могут быть изолированы по отдельности.
В бентосных морских районах с сильным выбросом метана из ископаемых резервуаров (например, на холодных выходах , грязевых вулканах или отложениях газовых гидратов ) АОМ может быть настолько высоким, что хемосинтезирующие организмы, такие как нитчатые серные бактерии (см. Beggiatoa ) или животные (моллюски, трубчатые черви) с симбионтами Сульфидокисляющие бактерии могут процветать за счет большого количества сероводорода , производимого во время АОМ. Бикарбоната (HCO 3 — ) , полученная от отита может (я) получить поглощенную в осадках осаждения карбоната кальция или так называемых метан , полученные аутигенных карбонаты и (II) получают выпущен в покрывающей толщу воды. Полученные из метана аутигенные карбонаты, как известно, являются наиболее обедненными 13 C карбонатами на Земле, со значениями δ 13 C до -125 промилле .
Эффект Пастера
Эффект Пастера — это снижение потребления глюкозы и прекращение продукции молочной кислоты клеткой в присутствии кислорода. Биохимическая основа эффекта заключается в конкуренции за субстрат между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и , превращающей пируват в лактат.
У пируватдегидрогеназы сродство гораздо выше и в обычных аэробных условиях она окисляет большую часть пировиноградной кислоты. Как только поступление кислорода уменьшается (анемии, нарушение кровообращения, спазм сосудов, тромбозы и т.п.) происходит следующее:
- внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется,
- моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот,
- ацетил-S-КоА не входит в ЦТК и вместе с НАДН ингибирует ПВК-дегидрогеназу.
В этой ситуации пировиноградной кислоте не остается ничего иного как превращаться в молочную.
При наличии кислорода ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
Отличной иллюстрацией к сказанному служит чувствительность миокарда и нейронов к недостатку кислорода:
Роль лактатдегидрогеназы в клетке
В норме работу клеток нервной системы и миокарда при аэробных условиях обеспечивает большое количество митохондрий и поступление из крови субстратов для окисления – глюкозы, кетоновых тел, жирных кислот (только для миокарда), лактата, превращегося в пируват.
В основе высокой чувствительности этих органов к отсутствию кислорода лежит изоферментов лактатдегидрогеназы друг от друга. Рассмотрим это на прмиере ЛДГ-1 и ЛДГ-5.
Сердечный изофермент ЛДГ-1, обладая высоким сродством к молочной кислоте, переводит ее в пировиноградную, «стремясь» поднять концентрацию пирувата с целью его включения в цикл трикарбоновых кислот (только в аэробных условиях) и получения энергии для сокращения миокардиоцита. Поэтому миокард не образует лактат, но зато может использовать его для получения энергии, захватывая из крови, но только в аэробных условиях. Аналогично лактат используется нервной системой.
При нехватке кислорода свойства изофермента ЛДГ-1 не изменятся, он по-прежнему будет сдвигать реакцию в сторону продукции пировиноградной кислоты (на схеме «справа-налево»). Однако без кислорода «сгореть» в ЦТК пируват не может и выйти из клетки тоже не может, т.к. клеточные мембраны непроницаемы для него. Являясь кислотой, он закисляет цитозоль, изменяя активность ферментов и, возможно, как-то еще проявляет токсичность. Таким образом, происходят необратимые повреждения кардиомиоцита и нейрона – развивается инфаркт миокарда. или ишемический инсульт.
В тоже время изофермент скелетной мышцы ЛДГ-5 обладает высоким сродством к пирувату, при отсутствии кислорода в клетке быстро и эффективно превращает его в молочную кислоту, обратная же реакция практически не идет. Закисление саркоплазмы снижает работоспособность миоцита. Мышца, хоть и не в состоянии работать в таких условиях, все-таки сохраняет жизнеспособность. Причина в том, что в клетке молочная кислота не накапливается – при помощи монокарбоксилатных переносчиков (monocarboxylate transporters – MCTs) она проходит через клеточные мембраны и относительно быстро удаляется из мышцы. После «отключки» скелетная мышца вновь становится работоспособной через несколько минут.
Таким образом, в анаэробных условиях сильнее всего будут страдать сердечная мышца и нервная система, что, собственно говоря, и наблюдается в медицинской практике.
Степень аэробности среды
Степень аэробности среды характеризуется прежде всего ее окислительно-восстановительным потенциалом – физической величиной, выражаемой в вольтах и измеряемой посредством потенциометрии. В среде, максимально насыщенной кислородом, показатель может достигать 41. При насыщении среды водородом он приближается к нулю. Число 28 позволяет делать выводы о том, что процессы окисления и равновесия сбалансированы.
Наблюдается четкая зависимость между окислительно-восстановительным потенциалом среды и параметрами жизнедеятельности организмов. Таким образом, воздействуя на него и меняя на свое усмотрение, можно регулировать их численность. Однако не стоит забывать и об обратной зависимости: выделяя продукты обмена, а также используя адаптационные механизмы, микроорганизмы также могут вилять на окислительно-восстановительный потенциал среды, в которой они находятся.
Гликолиз
Анаэробное превращение глюкозы локализуется в цитозоле и включает два этапа из 11 ферментативных реакций.
Первый этап гликолиза
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент глюкозофосфат-изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
- при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза,
- при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез глицеррол-3-фосфата для образования фосфатидной кислоты и далее тривцилглицеролов.
Второй этап гликолиза
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата до кислоты и присоединение к ней фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (использование энергии электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ с образованием пировиноградной кислоты и АТФ.
Последняя реакция бескислородного окисления глюкозы, одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы
Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях
| У плода и детей первых месяцев жизни преобладает анаэробный распад глюкозы, в связи с чем концентрация молочной кислоты в крови у них выше чем у взрослых. |
| При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА. |
Классификация анаэробов
Различают два основных типов анаэробов:
- Факультативы (кишечная палочка, стафилококк, стрептококк, шигелл). Приспособлены к существованию как в кислородной, так кислородсодержащей среде).
- Облигатные существуют исключительно в бескислородной среде. Малейший контакт с этим газом приводит к гибели этих организмов.
Облигатные микроорганизмы также делятся на две категории:
- Клостридии – возбудители развития ряда инфекций, в частности бутулизма, столбняка. Образуют споры.
- Неклостридиальные – не представляющие опасности как для человека, так и других живых существ. Это – бактериоды, эубактерии, пейллонеллы, пептококки. Не образуют споры.
В жидкой питательной среде факультативы равномерно распределены по всем ее слоям, облигатные же, избегая контакта с кислородом, сосредоточены в нижних.
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. . Второй метод (в центре) связывает окисление метана с восстановлением нитратов, которое осуществляется консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH4 + ТАК42− → HCO3− + HS− + H2О
Сульфатно-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных археи и сульфатредуцирующие бактерии. Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф». ANME очень тесно связаны с метаногенными археями, и недавние исследования предполагают, что AOM является ферментативным обращением метаногенез. До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это связано с тем, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не позволили изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что у архей ANME и SRB есть обязательный синтрофное взаимодействие и поэтому не может быть выделено индивидуально.
В бентосный морские районы с сильными выбросами метана из ископаемых резервуаров (например, на холодные просачивания, грязевые вулканы или же газовый гидрат депозитов) AOM может быть настолько высоким, что хемосинтетический такие организмы, как нитчатые серные бактерии (см. Beggiatoa) или животных (моллюски, трубчатые черви) с симбионт сульфидокисляющие бактерии могут процветать на большом количестве сероводород которые производятся во время AOM. Производство бикарбонат из АОМ может привести к осаждению карбонат кальция или так называемый аутигенный карбонаты. Эти аутигенные карбонаты, как известно, являются наиболее 13Карбонаты обедненные углеродом на Земле, с δ13Значения C до -125 промилле сообщил.
Аэробный режим энергообеспечения мышечной деятельности
Если при гликолизе исходным продуктом выработки энергии служат исключительно углеводы, то при аэробном режиме энергообеспечения мышечной деятельности организм использует все компоненты питания – углеводы, белки, жиры. Именно при аэробном процессе организм добывает энергии почти в двадцать раз больше, нежели при гликолизе. Причем конечные продукты реакций здесь практически нейтральны – вода и углекислый газ, который выводится из организма при дыхании.
На этот счет образное сравнение сделал всемирно известный биохимик А. Ленинджер. Если первые два пути ресинтеза АТФ (анаэробные режимы) он сравнил с работой поршневого двигателя, то третий путь – аэробный, – он приравнял к тяге двигателя ракетного.
Итак, существуют как бы три уровня энергообеспечения мышечной деятельности. Но помните, как сказано выше, использования креатинфосфата хватает на 10 – 15 секунд работы, гликолиза на 2 – 4 минуты… Способность человека к ресинтезу АТФ в данных случаях совершенно индивидуальны. Точно так же индивидуальны они и при аэробном механизме. С одной стороны, мощность и емкость (есть такие термины) каждого уровня обусловлены природой, с другой – диапазон каждого из них может быть расширен за счет тренировки.
Все это хорошо, скажет читатель recipehealth.ru, но каким образом, где претерпевают все превращения на пути к ресинтезу АТФ белки, жиры и углеводы. Представьте, для этого в каждой клетке есть своего рода энергетические подстанции. Название им – митохондрии. В недрах митохондрий и происходит беспрерывный процесс восстановления АТФ. И этот процесс идет в аэробном режиме.
В обычных условиях «работает» лишь часть митохондрий. Но по мере потребности мышц в энергии в процесс ресинтеза АТФ включается все больше и больше подстанций. Наконец, за дело берутся все! Но энергии для обеспечения мышечной деятельности нужно еще больше…
Вот так выглядит митохондрия (компьютерная инсталяция)
Митохондрии, как и все клетки организма, живут и отмирают. Идет постоянный процесс их обновления. Но вот в чем хитрость. Когда запросы организма в АТФ для энергообеспечения мышечной деятельности все возрастают, в клетках увеличивается и число митохондрий. Когда же и это число уже перестает удовлетворять запросы, убыстряется темп обновления.… Именно этот процесс имелся в виду, когда говорилось о том, что диапазон каждого энергетического уровня можно расширить за счет тренировки.
Вот, пожалуй, очень короткий и, конечно, весьма упрощенный взгляд на проблему энергообеспечения мышечной деятельности организма. Надеюсь, что понимание этого процесса, даже на изложенном уровне, поможет вам в выборе пути укрепления здоровья, расширив диапазон знаний о самом себе. Это был намек, а теперь, дорогие друзья, я призываю открытым текстом: увеличивайте количество своих митохондрий и скорость их обновления, используя информацию из рубрики «Спортзал»!
А вот что рассказывает о биохимических основах мышечной деятельности химик:
В сочетании с сульфатредукцией
Три механизма анаэробного окисления метана (АОМ). Первый метод (вверху) осуществляется консорциумом анаэробных метанотрофных (ANME) архей из клад 1,2a, 2b и 2c и сульфатредуцирующих бактерий (SRB). Окисление метана происходит в ANME, где электроны передаются непосредственно в SRB, который выполняет восстановление сульфата. . Второй метод (в центре) связывает окисление метана с восстановлением нитратов, которое осуществляется консорциумом архей ANME и бактерий Anammox. Третий механизм (внизу) также связывает окисление метана с восстановлением нитратов, но его опосредуют археи ANME и бактерии NC10. В отличие от первых двух механизмов, и археи ANME, и бактерии NC10 конкурируют за метан.
Общая реакция такова:
- CH4 + ТАК42− → HCO3− + HS− + H2О
Сульфатно-управляемый АОМ опосредуется синтрофным консорциумом метанотрофных археи и сульфатредуцирующие бактерии. Часто они образуют небольшие агрегаты, а иногда и объемные маты. Партнер архей сокращенно АНМЕ, что означает «анаэробный метанотроф». ANME очень тесно связаны с метаногенными археями, и недавние исследования предполагают, что AOM является ферментативным обращением метаногенез. До сих пор плохо изучено, как взаимодействуют синтрофические партнеры и какие промежуточные продукты обмениваются между архейной и бактериальной клеткой. Исследованию АОМ препятствует тот факт, что ответственные организмы не были изолированы. Это связано с тем, что эти организмы демонстрируют очень медленные темпы роста с минимальным временем удвоения в несколько месяцев. Бесчисленные усилия по изоляции не позволили изолировать один из анаэробных метанотрофов, возможное объяснение может заключаться в том, что у архей ANME и SRB есть обязательный синтрофное взаимодействие и поэтому не может быть выделено индивидуально.
В бентосный морские районы с сильными выбросами метана из ископаемых резервуаров (например, на холодные просачивания, грязевые вулканы или же газовый гидрат депозитов) AOM может быть настолько высоким, что хемосинтетический такие организмы, как нитчатые серные бактерии (см. Beggiatoa) или животных (моллюски, трубчатые черви) с симбионт сульфидокисляющие бактерии могут процветать на большом количестве сероводород которые производятся во время AOM. Производство бикарбонат из АОМ может привести к осаждению карбонат кальция или так называемый аутигенный карбонаты. Эти аутигенные карбонаты, как известно, являются наиболее 13Карбонаты обедненные углеродом на Земле, с δ13Значения C до -125 промилле сообщил.
Что такое гликолиз
В общих чертах, гликолиз — это процесс, который происходит в цитоплазме всех клеток: от низших бактерий до высших млекопитающих — людей. Для некоторых это единственный метаболический путь доставки энергии клетке — например, для бактерий, для других же это метаболический путь, в который «сливаются» и другие метаболиты — белки и липиды.
Гликолиз — это основной путь расщепления глюкозы в нашем организме, основное биологическое значениеэтого процесса заключается в получении энергии и других продуктов обмена.
 Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
Гликолиз происходит как в аэробных, так и в анаэробных условиях. Процесс в анаэробных условиях (недостаток кислорода) называется анаэробным гликолизом — конечным продуктом лактата и ферментации в дрожжах — алкогольной или молочнокислой ферментации.
При наличии кислорода этот процесс называется аэробным гликолизом — конечным продуктом выступают CO2 и H2O,
Гликолиз представляет собой серию реакций, в которых одна молекула глюкозы распадается на две молекулы пирувата. Но так происходит не всегда, в случаях когда доступ кислорода в этой реакции затруднен, проще говоря, в анаэробных условиях, то пируват превращается в лактат или спирт.
Механизмы анаэробного метаболизма: гликолиз в анаэробных условиях
В анаэробных условиях O2 отсутствует. Отсутствие конечного субстрата O2 ингибирует активность дыхательных структур (до этого они неактивны), и таким образом конечным продуктом распада глюкозы в анаэробных условиях является лактат,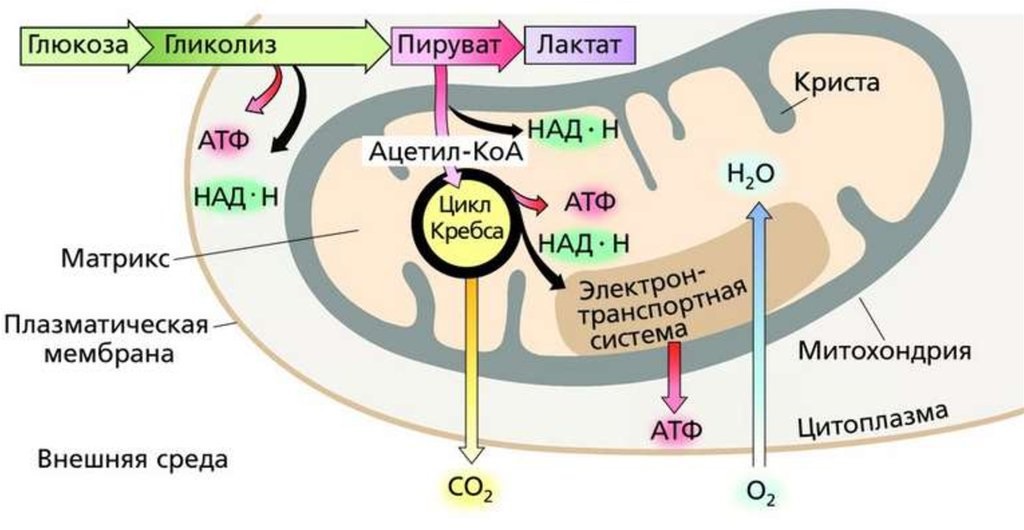
Анаэробный распад глюкозы в физиологических условиях наблюдается в эритроцитах (без митохондрий) и в сильно сокращающихся мышцах (недостаточное кровоснабжение кислородом), это наблюдается при сильной физической работе — присутствует истощение O2 в мышечных клетках (в форме оксимиоглобина).
Лактат в мышечных клетках приводит к мышечной лихорадке, которая преодолевается неинтенсивной мышечной активностью, направленной на полное расщепление лактата в мышцах, до CO2 , H2O и H2 в результате аэробного гликолиза.
При патологических состояниях и онкологических заболеваниях, у многих людей наблюдается так называемый эффект Пастера, при котором клетки из-за уменьшенного поступления крови или кислорода переключаются на анаэробный распад глюкозы, связанный с повышенным ее потреблением (повышенная экспрессия трансмиттеров глюкозы GLUT1 ) и гипогликемией.
Анаэробный гликолиз, как при физиологических, так и при патологических состояниях, характеризуется повышенным уровнем конечного продукта в результате расщепления его лактата в плазме крови — лактатемией, что может привести к ацидозу.
Дальнейшее расщепление лактата
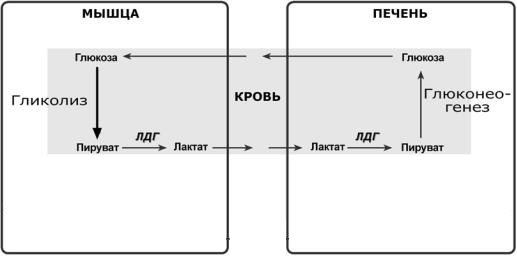
Лактат метаболизируется из печени в пируват, катализируя реакцию в обратном направлении, и глюкоза синтезируется пируватом с использованием ферментов глюконеогенеза в печени через цикл Кори (лактатный цикл).
Вот в этой схеме и кроется ответ на вопрос о том, как влияет анаэробный гликолиз на производство энергии, ведь мы видим, что наша молочная кислота, образовавшаяся в мышцах, через кровь попадает в печень и участвует в процессе глюконеогенеза — создания глюкозы из неуглеводных продуктов.
В сочетании с восстановлением нитратов и нитритов
Общие реакции:
- CH4 + 4НО3− → CO2 + 4НО2− + 2H2О
- 3CH4 + 8НО2− + 8H+ → 3CO2 + 4N2 + 10H2О
Недавно было показано, что ANME-2d отвечает за АОМ, управляемый нитратами. Анме-2д, названный Methanoperedens nitroreducens, способен выполнять АОМ, управляемый нитратами, без организма-партнера посредством обратного метаногенеза с нитратом в качестве конечного акцептора электронов, используя гены восстановления нитрата, которые были переданы латерально от бактериального донора. Это также был первый полный путь обратного метаногенеза, включая mcr и мер гены.
В 2010 году омикс-анализ показал, что восстановление нитрита может быть связано с окислением метана одним видом бактерий, NC10, без участия архейного партнера.
Распространение и экологическое значение[править | править код]
Абсолютное большинство исследований по данной тематике выполнено для донных морских и океанических осадков, однако показано, что процесс протекает и в почве, рубце желудка жвачных, пресноводных водоёмах.
Метан является сильным парниковым газом с потенциалом теплопоглощения в 30 раз больше чем у CO2. По разным оценкам от 30 до 90 % метана образуется биогенно, в основном в донных осадках и почвах переувлажнённых ландшафтов. Анаэробное окисление метана препятствует его эмиссии в атмосферу. Его масштабы оцениваются в 6-20 % от общего количества ежегодно выделяющегося из океана в атмосферу метана, и предполагается, что эти цифры будут пересмотрены в сторону увеличения. Оценок объёмов анаэробного окисления метана в наземных экосистемах пока не существует.