Текст книги «эргогенные эффекты спортивного питания. научно-методические рекомендации для тренеров и спортивных врачей»
Содержание:
- 12.4. Механизмы энергообеспечения мышечной ткани
- Миозин в мышечных волокнах
- Саркоплазма мышечных волокон
- Строение мышц (мышечных волокон) человека
- Особенности проведения возбуждения в нервно-мышечном синапсе
- Механизм синаптической передачи
- Механизм сокращения поперечно-полосатых мышц
- 12.5. Изменение метаболизма при мышечной работе
- Мышечная система человека
- Мышечные сокращения
12.4. Механизмы энергообеспечения мышечной ткани
Источники энергии следующие.
- Специальные реакции субстратного фосфорилирования.
- Гликолиз, гликогенолиз.
- Окислительное фосфорилирование.
1. Специальные реакции субстратного фосфорилирования. 1.1. Креатинфосфокиназная реакция. Максимально эффективен.дает побочных нежелательных продуктов1.2. Миокиназная реакция.1.3. Гликолиз, гликогенолиз.Недостатки следующеи.
- Небольшая эффективность: 3 АТФ на один глюкозный остаток гликогена.
- Накопление недоокисленных продуктов (лактат).
- Гликолиз начинается не сразу — только через 10-15 с после начала мышечной работы.
- Окислительное фосфорилирование.
Преимущества.
- Это наиболее энергетически выгодный процесс — синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы.
- Имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела.
- Продукты распада (CO2 и H2O) практически безвредны.
Недостаток: требует повышенных количеств кислорода.
Миозин в мышечных волокнах
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина – 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две – легкие 20 и 17 кДа.
Рис. 1. Состав и структура молекулы миозина
Состав и структура молекулы миозина
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
На верхнем конце стержня две нити расходятся, сплетаются с дополнительными двумя легкими цепями и формируют две миозиновые головки. За счет головок длина миозиновой молекулы достигает 150 нм , а толщина – 2 нм. По этим характеристикам молекула миозина превосходит все молекулярные структуры, имеющиеся в природе.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
Более подробно строение и функции мышц описаны в моих книгах:
- Гипертрофия скелетных мышц человека
- Биомеханика опорно-двигательного аппарата человека
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2).
Рис.2. Молекула миозина состоит из двух длинных полипептидов (тяжелых цепей), формирующих две глобулярные головки и стержнеобразный хвост, участвующий в образовании толстого филамента. Головки содержат актин-связывающие участки (А) и моторные области (М), где происходит связывание и расщепление АТФ. Вблизи головок с тяжелыми цепями ассоциированы две пары легких цепей, одна из которых содержит участок фосфорилирования (Ф).
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
Рис.3. Молекула миозина и толстый филаментРис.4. Толстый филамент
Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.
Более подробно строение и функции мышц описаны в моих книгах:
- Гипертрофия скелетных мышц человека
- Биомеханика опорно-двигательного аппарата человека
- Бендолл Дж. мышцы, молекулы и движение.- М.: Мир, 1970.- 256 с.
- Самойлов В.О., Бигдай Е.В. Клеточные и молекулярные основы биомеханики / В кн.: Математические модели и компьютерное моделирование в биомеханике: Учебное пособие.- СПб: Из-во Политехнического ун-та, 2004.- С. 29-102.
Саркоплазма мышечных волокон
Объем внутри мышечного волокна заполнен желеобразным коллоидным раствором – саркоплазмой. В ней протекают активные биохимические процессы расщепления и синтеза разнообразных органических веществ, обеспечивающих энергетическое снабжение сократительного аппарата.
Внутри саркоплазмы мышечного волокна содержатся:
- органеллы специального назначения (миофибриллы);
- органеллы общего назначения,
- включения.
Об органеллах специального назначения (миофибриллах) уже было подробно рассказано, также очень подробно описаны органеллы общего назначения: ядра, митохондрии, саркоплазматический ретикулум, рибосомы, лизосомы, комплекс Гольджи. Теперь подробнее остановимся на включениях. Включения мышечного волокна содержат: белки, экстрактивные вещества, углеводы, жиры и многое другое.
Более подробно строение и функции мышц описаны в моих книгах «Гипертрофия скелетных мышц человека» и «Биомеханика мышц«
Белки саркоплазмы
На долю белков саркоплазмы приходится 25-30% белков мышц.
Во-первых, к белкам саркоплазмы можно отнести все белки, которые необходимы для миофибриллогенеза (синтеза миофибрилл) и для обеспечения структуры мышечного волокна. Так как наши мышечные волокна постоянно разрушаются и синтезируются, следовательно, в саркоплазме должны обязательно присутствовать белки из которых строятся миофибриллы. К таким белкам относятся: миозин (основной белок толстого филамента), актин, тропонин и тропомиозин (основные белки тонкого филамента), титин (соединяет толстый филамент с Z-диском), десмин, виментин, синемин, дистрофин, спектрин (белки, участвующие в привязке миофибрилл друг к другу и к сарколемме мышечного волокна).
Во-вторых, одним из необходимых компонентов саркоплазмы является белок миоглобин. Посредством этого белка осуществляется перенос кислорода внутри мышечного волокна.
В-третьих, в саркоплазме находятся различные ферменты. Напомню, что ферменты — это особые белки, выполняющие функцию катализаторов химических реакций. Среди саркоплазматических белков можно выделить следующие:
- АТФ-азу — фермент, принимающий активное участие в сокращении мышечного волокна, так как он является катализатором реакции гидролиза, при которой происходит выделение энергии.
- Креатинкиназу — фермент, который участвует в креатинфосфатном пути ресинтеза АТФ. При повреждении мышечных волокон концентрация креатинкиназы в крови возрастает.
- Основные ферменты гликолиза: фосфорилазу и фосфофруктокиназу, расщепляющие гликоген или глюкозу до пировиноградной или молочной кислоты.
Помимо белков в саркоплазме содержатся аминокислоты, из которых синтезируются белки. В большом количестве имеется глутаминовая кислота и глутамин.
Экстрактивные вещества
В саркоплазме также содержатся небелковые азотсодержащие вещества. Среди них: АТФ, АДФ и АМФ. К экстрактивным веществам относится креатинфосфат, креатин и креатинин.
Углеводы саркоплазмы
В саркоплазме имеется основной углевод – гликоген. Свободной глюкозы в саркоплазме мало. При мышечном сокращении в саркоплазме накапливаются продукты углеводного обмена – лактат и пируват.
Также в саркоплазме мышечных волокон имеются капельки жира. И, конечно, одним из основным компонентов саркоплазмы является вода.
Сокращение мышечного волокна
При сокращении мышечного волокна в саркоплазму из саркоплазматического ретикулума выделяются ионы кальция. После окончания сокращения мышечного волокна ионы кальция закачиваются обратно в саркоплазматический ретикулум посредством кальциевого насоса.
В саркоплазме мышечных волокон имеются ионы калия (К+). Во время сокращения мышечного волокна ионы калия через калиевые каналы выходят из мышечного волокна в тканевую жидкость, а в саркоплазму мышечного волокна проникают ионы натрия (Na+). После окончания сокращения мышечного волокна посредством натрий-калиевых насосов (Na+— К+) ионы калия закачиваются в саркоплазму мышечного волокна, а ионы натрия – в тканевую жидкость, окружающую мышечные волокна.
Вязкость саркоплазмы
Саркоплазма обладает сравнительно высокой вязкостью, которая еще больше возрастает при возбуждении мышечного волокна. Вследствие этого она оказывает сопротивление укорочению миофибрилл, то есть создает внутреннее трение и в большей или меньшей мере замедляет сокращение или расслабление мышцы.
Строение мышц (мышечных волокон) человека
Мышцы человека состоят из мышечных волокон, которые в свою очередь состоят из мышечных клеток. Взятое в отдельности мышечное волокно представляет собой многоядерную мышечную клетку, диаметр которой варьируется от 10 до 100 мкм, которая имеет оболочку сарколемму (клеточная мембрана), заполненной саркоплазмой (содержимое клетки, основа которой — матрикс). Миофибриллы располагаться в саркоплазме, то есть саркоплазма заполняет пространство между миофибриллами и окружает ядра клеток. Миофибрилла представляет собой нитевидной формы образование, состоящее из саркомеров (сократительный аппарат мышцы).
Строение скелетной мышцы
В зависимости от количества миофибрилл, различают белые и красные мышечные волокна.
Белые мышечные волокна отличаются от красных, большим количеством миофибрилл, и меньшим саркоплазмы, такое соотношение обеспечивает быстроту сокращение белых волокон. Благодаря наличию миоглобина (кислородосвязывающий белок) в мышцах, который придает цвет, мышечные волокна называют красными.
Саркоплазма в мышечных клетках содержит помимо миофибрилл, еще и митохондрии (энергетические станции клеток, в которых синтезируются АТФ), рибосомы, комплекс Гольджи, жировые включения, и другие постоянные компоненты клетки, без которых существование ее не возможно (органоиды).
Актин – сократительный белок, на который приходиться около 15% от всего мышечного белка, содержится в тонких филаментах скелетных мышц, обеспечивая осуществление двигательных функций клеток.
Миозин – основной белок, из которого состоят мышечные волокна, благодаря которому мышцы имеют эластичность и способны сокращаться. Масса миозина составляет порядка 55% от всех сократительных белков, которые содержаться в мышечных волокнах.
Миозин сконцентрирован в поперечнополосатых мышцах (скелетной мускулатуре), которые отвечают за рефлексы и целенаправленность движений. Благодаря способности миозина расщеплять АТФ химическая энергия макроэргических связей АТФ переходит в механическую энергию мышечного сокращения.
Строение мышц человека
Актомиозин – комплекс, состоящий из белков актина и миозина, создает мышечные волокна, которые распределяются в определенном порядке. Сокращение актомиозина возможно, благодаря энергии, которая освобождается в результате взаимодействия АТФ с водой (гидролиз), таким образом, актомиозин определяет способность мышц к сокращению (мышечное сокращение).
Особенности проведения возбуждения в нервно-мышечном синапсе
Одностороннее проведение возбуждения — только в направлении от пресинаптического окончания к постсинаптической мембране.
Суммация возбуждения соседних постсинаптических мембран.
Синаптическая задержка — замедление в проведении импульса от нейрона к мышце составляет 0,5-1 мс. Это время затрачивается на секрецию медиатора, его диффузию к постсинаптической мембране, взаимодействие с рецептором, формирование ПКП, их суммацию.
Низкая лабильность — она составляет 100-150 имп/с для сигнала, что в 5-6 раз ниже лабильности нервного волокна.
Чувствительность к действию лекарственных веществ, ядов, БАВ, выполняющих роль медиатора.
Утомляемость химических синапсов — выражается в ухудшении проводимости вплоть до блокады в синапсе при длительном функционировании синапса. Главная причина утомляемости — исчерпание запасов медиатора в пресинаптическом окончании.
Законы проведения возбуждения по нервам:
- Закон функциональной целостности нерва.
- Закон изолированного проведения возбуждения.
- Закон двустороннего проведения возбуждения.
В зависимости от скорости проведения возбуждения нервные волокна подразделяются на 3 группы: A, B, C. В группе A выделяют 4 подгруппы: альфа, бетта, гамма и сигма.
Механизм синаптической передачи
4 этап
Ионы Ca вызывают образование специального белкового комплекса, который включает в себя везикулу и структуры, расположенные непосредственно около пресинаптической мембраны.
Они связаны между собой так называемыми белками экзоцитоза.
Часть белков расположена на везикулах (синапсин, синаптотагмин, синаптобревин), а часть — на пресинаптической мембране (синтаксин, синапсо-ассоциированный белок). Данный комплекс получил название секретосома.
Излитию содержимого пузырька в щель способствует белок синаптопорин, формирующий канал, по которому идет выброс медиатора.
Квант медиатора — количество молекул, содержащихся в одной везикуле.
На 1 ПД выбрасывается 100 квантов АХ.
10 этап
На постсинаптической мембране возникает потенциал концевой пластинки (ПКП). Он является аналогом локального ответа (ЛО).
Потенциал действия на постсинаптической мембране не возникает! Он формируется на соседней мембране мышечного волокна.
Судьба медиатора:
- связывание с рецептором,
- разрушение ферментов (ацетилхолинэстеразой),
- обратное поглощение в пресинаптическую мембрану,
- вымывание из щели и фагоцитоз.
События в синапсе:
- ПД приходит к терминали аксона;
- Он деполяризует пресинаптическую мембрану;
- Ca2+ входит в терминаль, что приводит к выделению АХ;
- В синаптическую щель выделяется медиатор АХ;
- Он диффундирует в щель и связывается с рецепторами постсинаптической мембраны;
- Меняется проницаемость постсинаптической мембраны для ионов Na+;
- Ионы Na+ проникают в постсинаптическую мембрану и уменьшают ее заряд — возникает потенциал концевой пластинки (ПКП).
На самой постсинаптической мембране ПД возникнуть не может, так как здесь отсутствуют потенциалзависимые каналы, они являются хемозависимыми!
- ПКП суммируются и достигают КУД на соседнем участке мышечного волокна, что приводит к возникновению ПД и его распространению по мышечному волокну (около 5 м/с).
Достигнув пороговой величины, то есть КУД, ПКП возбуждает соседнюю (внесинаптическую) мембрану мышечного волокна за счет местных круговых токов.
Механизм сокращения поперечно-полосатых мышц
Любая скелетная мышца состоит из мышечных волокон, которые, в свою очередь, состоят из множества тонких нитей — миофибрилл, расположенных продольно. Каждая миофибрилла состоит из протофибрилл — нитей сократительных белков: миозина (миозиновая протофибрилла), актина (актиновая протофибрилла).
Кроме сократительных белков в миофибрилле имеются два регуляторных белка: тропомиозин и тропонин.
Миозиновые волокна соединены в толстый пучок, от которого в торону актиновых нитей отходят поперечные мостики. У каждого мостика выделяют шейку и головку.
Нить актина располагается в виде 2 скрученных ниток бус. На ней имеются актиновые центры.
Тропомиозин в виде спиралей оплетает поверхность актина, закрывая в покое ее центры. Одна молекула тропомиозина контактирует с 7 молекулами актина.
Тропонин образует утолщение на конце каждой нити тропомиозина.
Под влиянием возникшего в мышечном волокне ПД из саркоплазматического ретикулума (СПР — депо Ca2+) высвобождаются ионы Ca. Кальций связывается с тропонином, который смещает тропомиозиновый стержень, что приводит к открытию актиновых центров.
В результате, к актиновым центрам присоединяются головки поперечных миозиновых мостиков.
Эти постики совершают «гребущие движения», в результате чего нити актина перемещаются этими мостиками относительно волокон миозина, происходит укорочение мышцы.
Процесс расслабления происходит в обратной последовательности с использованием энергии АТФ за счет функционирования кальциевого насоса.
При отсутствии повторного импульса ионы Ca не поступают из СПР. В результате отсутствия Ca-тропонинового комплекса, тропомиозин возвращается на свое прежнее место, блокируя актиновые центры актина. Актиновые протофибриллы легко скользят в обратном направлении благодаря эластичности мышцы, и мышца удлиняется (расслабляется).
12.5. Изменение метаболизма при мышечной работе
-
Дальше изменения метаболизма зависят от интенсивности мышечной работы:
- если мышечная работа длительная и небольшой интенсивности, то в дальнейшем клетка получает энергию путем окислительного фосфорилирования — это работа в «аэробной зоне»;
- если мышечная работа субмаксимальной интенсивности, то — дополнительно к окислительному фосфорилированию включается гликолиз — это наиболее тяжелая мышечная работа — возникает «кислородная задолженность», это — работа «в смешанной зоне»;
- если мышечная работа максимальной интенсивности, но непродолжительная, то механизм окислительного фосфорилирования не успевает включаться. Работа идет исключительно за счет гликолиза. После окончания максимальной нагрузки лактат поступает из крови в печень, где идут реакции глюконеогенеза, или лактат превращается в пируват, который дальше окисляется в митохондриях (ГДФ-путь). Для окисления пирувата нужен кислород, поэтому после мышечной работы максимальной и субмаксимальной интенсивности потребление кслорода мышечными клетками повышено — возвращается кислородная задолженность (долг).
Красные мышцыБелые мышцыУ человека нет специализированных мышц, но есть специализированные волокна:Существует наследственная предрасположенность к мышечной работеколичество актина и миозина возрастает
Мышечная система человека
Мышечная система человека позволяет координировать движения тела, держать его в равновесии, осуществлять дыхание, а также транспорт пищи и крови внутри организма, помимо всего она защищает внутренности от повреждений, а также выполняет роль преобразователя энергии химической в механическую и тепловую.
В теле человека всего три типа мышц:
- скелетные
- гладкие
- мышца сердца
Мышечная система человека (A — мышца сердца, B — скелетные мышцы, C — гладкие мышцы)
Скелетная мускулатура
Скелетная мускулатура человека, она же поперечнополосатая, крепится к костям, состоит из волокон, а они в свою очередь состоят из мышечных клеток. В каждой мышечной клетке имеется два ядра, которые отвечают за деление и восстановление. За сокращение мышцы отвечают, так называемые миофибриллы (нити), которые содержаться в мышечных клетках. Количество миофибрилл в мышечной клетке может достигать до несколько тысяч. Таким образом, мышечные клетки формируют ткань, а она в свою очередь образовывает мышцу.
Наши скелетные мышцы содержат волокна, нервные окончание и кровеносные сосуды. Сокращение мышцы происходит с помощью нервных импульсов, которые поступают от спинного мозга до мышечной ткани, то есть передача нервного импульса осуществляется по пути — головной мозг → спинной мозг → нужные нам мышцы. Теперь понятно, почему повреждение спинного мозга так опасно.
Человек регулирует интенсивность сокращения мышц с помощью силы подаваемого импульса по нервным окончаниям.
Скелетная мускулатура человека
Гладкие мышцы
Гладкая мускулатура выполняет не произвольные сокращения, состоит из веретеновидных клеток, являясь одной из самых важных составляющих мышечных полых органов, а также составной частью кровеносных и лимфатических сосудов, помогает транспортировать содержимое полых органов (транспорт пищи кишечнику), сужения зрачка, корректировка артериального давления, и другие процессы, которые происходят непроизвольно.
Все сокращения гладким мышц не вызывают утомления, регулируются вегетативной системой (автономная нервная система, которая отвечает за работу внутренних органов).
Натренировать гладкие мышцы можно, например, увеличивая выносливость, вы улучшаете работу сердечно-сосудистую системы.
Гладкие мышцы
Сердечная мышца
Сердце непрерывно сокращается в течении всей жизни, обеспечивая движение, перекачку крови, питательных веществ, других жизненно-важных веществ по сосудам к тканям организма. Выполняя роль насоса, сердце работает в режиме непрерывных, ритмичных, одиночных сокращений.
Строение волокна миокарда, напоминает структуру скелетных мышц, которые также содержат миофибриллы, состоящие из актина и миозина, включая тропонин-тропомиозиновый белковый комплекс.
Картинку сердце, где показанна устройство сердца где можно увидеть миокард
Механизм мышечного сокращения сердца, происходить все по тем же причинам, что и в поперечнополосатых мышцах, благодаря ионами Ca2+ (кальция), которые освобождаются из саркоплазматического ретикулума (мембранная органелла мышечных клеток), только в этом случае он менее упорядочен (по сравнению со скелетной мускулатурой).
Сердечная мышца и ее устройство
Мышечные сокращения
Сокращение мышцы может наступить при условии, если сила раздражения достигает определенной величины. Наименьшая сила раздражения, вызывающая самое слабое сокращение мышцы, называется пороговым раздражением. Раздражение меньшей силы, чем пороговое (оно не вызывает сокращения мышцы), называется подпороговым, а раздражение большей силы — надпороговым.
Степень сокращения мышц до известного предела зависит от силы раздражения. Дело в том, что мышечные волокна, входящие в состав каждой мышцы, обладают разной степенью возбудимости: одни сокращаются в ответ на меньшую силу раздражения (высокая возбудимость), другие — в ответ на большую (низкая возбудимость). Поэтому увеличение силы раздражения выше пороговой до определенного предела будет сопровождаться повышением степени сокращения.
При изучении сокращений скелетных (поперечнополосатых) мышц принято различать одиночное мышечное сокращение и длительное (суммарное) сокращение, или тетанус.
Одиночное сокращение можно вызвать только искусственно в лаборатории на нервно-мышечном препарате. Оно возникает в ответ на одно кратковременное раздражение (один импульс). На миограмме одиночного мышечного сокращения (рис. 51, А) различают три периода. Мышца начинает сокращаться всегда через некоторое время после раздражения. Первый период — между приложением раздражителя и началом сокращения мышцы — называют периодом скрытого возбуждения, или латентным периодом. Для мышц человека он измеряется тысячными долями секунды. Затем следует второй период — период сокращения, или укорочения мышцы, и за ним третий — период расслабления мышцы.
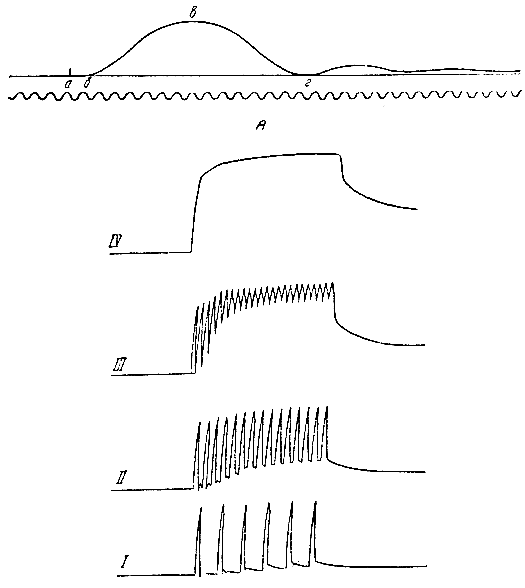 Рис. 51. А — кривая одиночного мышечного сокращения, а — момент раздражения; б — начало сокращения; а, б — латентный период; б, в, г — кривая сокращения мышцы. Б — различные виды тетануса. I — одиночные сокращения; II, III — зубчатый тетанус; IV — гладкий тетанус
Рис. 51. А — кривая одиночного мышечного сокращения, а — момент раздражения; б — начало сокращения; а, б — латентный период; б, в, г — кривая сокращения мышцы. Б — различные виды тетануса. I — одиночные сокращения; II, III — зубчатый тетанус; IV — гладкий тетанус
Возбудимость мышц в течение одиночного сокращения изменяется. Так, в латентном периоде мышца вначале не возбудима (рефрактерная фаза), в периоде сокращения возбудимость мышцы постепенно возрастает и достигает уровня более высокого, чем в состоянии покоя (фаза экзальтации), вслед за этим, в период расслабления, возбудимость мышцы падает. К периоду покоя возбудимость мышцы возвращается к исходному уровню.
В целом организме имеют место не одиночные, а длительные, или тетанические, сокращения скелетных мышц (тетанус). Тетанические сокращения являются результатом того, что в организме раздражения к мышцам из центральной нервной системы по нервам поступают не в виде однократных импульсов, а одно за другим. Форма длительного (тетанического) сокращения зависит от частоты импульсов. Если частота импульсов меньше продолжительности одиночного сокращения (0,1 секунды), то возникает серия одиночных мышечных сокращений (рис. 51, Б, I). Если частота будет больше и следующий импульс будет поступать в момент расслабления мышцы, сокращение приобретет форму зубчатого тетануса (рис. 51, II и III). При дальнейшем возрастании частоты импульсов они будут поступать в мышцу в фазу экзальтации. При этом возникает гладкий тетанус, характеризующийся непрерывными сокращениями (рис. 51, Б, IV). Частота импульсов столь велика, что новое возбуждение в мышце возникает раньше, чем закончилось предыдущее сокращение.
Таким образом, форма мышечного сокращения зависит от частоты импульсов, а величина сокращения — как от силы, так и от частоты раздражений.
Как установил Н. Е. Введенский, существует наилучший, или оптимальный, ритм раздражений, при котором степень сокращения (высота тетануса) будет наибольшей. Для разных скелетных мышц человека оптимальный ритм колеблется в пределах от 100 до 200 импульсов в секунду.
Мышечный тонус. Мышцы в живом организме никогда, даже при покое, не бывают полностью расслабленными. Обычное состояние любой мышцы — состояние некоторого напряжения, или тонуса. Мышечный тонус вызывается редкими импульсами, поступающими в мышцы из центральной нервной системы. При тонических сокращениях мышц в отличие от тетанических обмен веществ в них заметно не повышен. Благодаря мышечному тонусу поддерживается устойчивость и положение тела.